La vida. La cèl·lula: Les peces de la vida.
La química de la vida. Components bàsics. Proteïnes i enzims. Àcids nucleics
La química de la vida
Els sers vius presenten una enorme quantitat de compostos químics que classifiquem a grans trets en quatre grups:
- i) Proteïnes i enzims. De gran especificitat tant estructural i catalitzadors de reaccions. Hi ha de l’ordre de 1012 proteïnes diferents.
- ii) Àcids nucleics. Capaços de duplicar-se i de contenir la informació per sintetitzar les proteïnes. El ATP transporta grups fosfat per funcions energètiques.1010 AN diferents.
- iii) Hidrats de carbó usats com a reserva d’energia (midó) o com a estructura (cel·lulosa).
- iv) Lípids, molècules insolubles que tenen un paper a les membranes, reserva d’energia i regulació hormonal.
L’enorme diversitat de proteïnes i àcids nucleics s’aconsegueix amb un nombre reduït de components bàsics, 20 aminoàcids i 8 nucleòtids.
La matèria viva és una dissolució col·loidal principalment de proteïnes (+àcids nucleics, sucres i lípids) limitats per una membrana.
L’aigua forma el 70% de la matèria viva. Es especialment adequada perquè té punts de fusió i ebullició elevats, i una alta calor específica. Això dóna estabilitat. D’altra banda la polaritat de les molècules tenen un paper important en l’estructura de les proteïnes.
[Cada cèl·lula és una olla on es cou un caldo de proteïnes i, mercès a l’especificitat dels enzims [“eines moleculars”], tenen lloc simultàniament i sense interferir molts processos químics diferents, sense energia elèctrica ni tèrmica (màquina química isoterma) i sense subproductes ni deixalles.]
Components bàsics
Aminoàcids
R-H.NH2.C-COOH amb 20 radicals diferents.
Alanina (Ala), leucina (Leu), isoleucina (Ile), valina (Val), prolina (Pro), fenilalanina (Phe), triptòfan (Trp), metionina (Met), glicocola (Gly), serina (Ser), treonina (Tre), cisteína (Cys), tirosina (Tyr), asparagina (Asn), glutamina (Gln), àcid aspàrtic (Asp) a. glutàmic (Glu), arginina (Arg), lisina (Lys), histidina (His).
Tots els aminoàcids tenen l’estructura R – C – C = O [on el grup NH2 OH carboxil dels àcids ha canviat -H per -OH] amb un grup carboxil i un amida. (Lehninger 73). Els 20 aminoàcids difereixen en el radical i es classifiquen en
- i) No polars o hidròfobs: alanina (Ala), leucina (Leu), isoleucina (Ile), valina (Val), prolina (Pro), fenilalanina (Phe), triptòfan (Trp), metionina (Met)(8).
- ii) Neutre polar: glicocola (Gly), serina (Ser), treonina (Tre), cisteína (Cys), tirosina (Tyr), asparagina (Asn), glutamina (Gln)(9).
- iii) Càrrega negativa (àcids): (àcid aspàrtic (Asp) a. glutàmic (Glu) -> asparagina i glutamina) (2)
- iv) Càrrega positiva (bàsics): arginina (Arg), lisina (Lys), histidina (His)(3)

Bases dels àcids nucleics
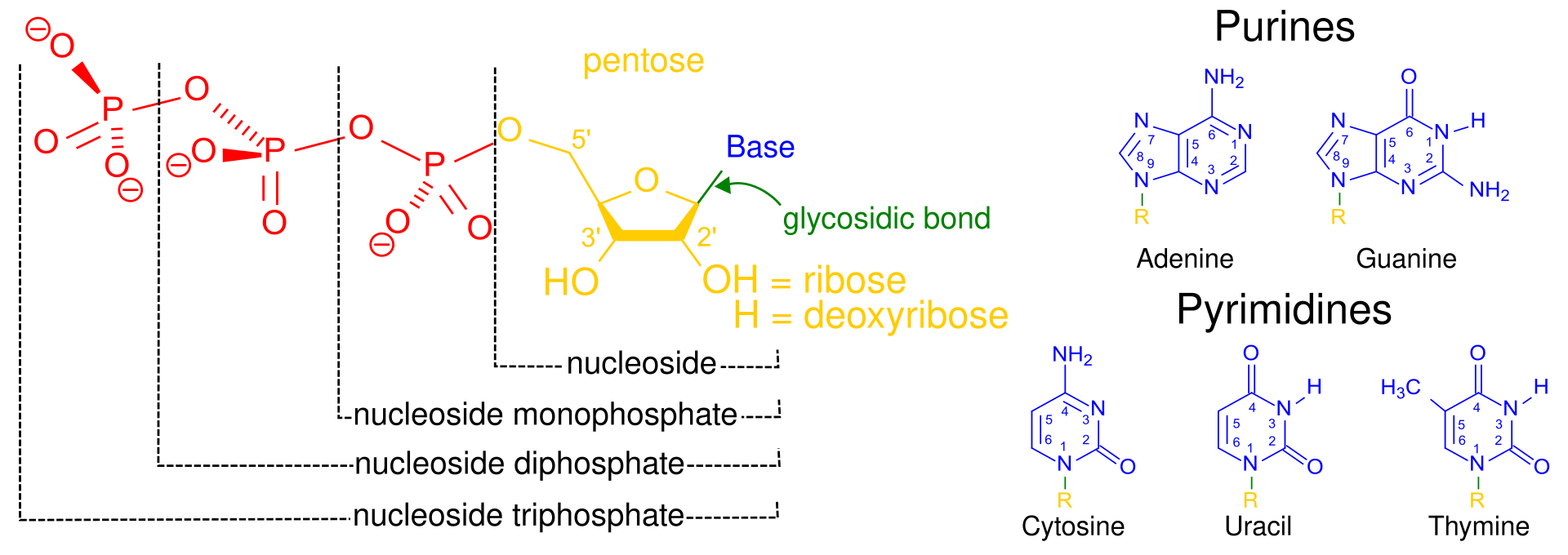
Uracil, timina, citosina (pirimidines, aromàtics de 6) i adenina i guanina (purines, aromàtics 5-6)
Les pirimidines uracil, timina i citosina ((cíclics de 6) i les purines com l’adenina i guanina (cíclis 5-6) són les quatre bases dels àcids nucleics. (Lehninger 23, 315). [En el DNA hi juguen TCAG i en el RNA UCAG].
Un nucleòtid està compost per una base nitrogenada, un sucre de cinc carbonis (ribosa o 2- desoxiribosa) i un grup fosfat.[
Hidrats de carbó
Ribosa, pentosa.
Els sucres més corrents són hidrocarburs cíclics amb el grup CH2OH, pentoses (C5H10O5) com la ribosa i hexoses (C6H12O6) com la glucosa. (lehninger 23, 255). Poden tenir funcions de reserva com el midó i el glucògen o estructurals com la cel.lulosa.
Precursors dels lípids
FQ614.OS Glicerina, àcids grassos, triglicèrids, esteroides, prostaglandina.
Els precursors dels lípids són la glicerina (CH2OH-CHOH-CH2OH), la colina i àcids grasos com el palmític (CH3-CH2-…-CH2-COOH). Els triglicèrids són lípids de reserva formats per tres molècules d’àcids grassos esterificats amb els tres grups hidròxils de la glicerina. Els fosfoglicèrids es troben a les membranes (àcid gras+glicerilfosfat). Els terpens (isoprè) i esteroides com el colesterol, testosterona, i les prostaglandines tenen un paper com a reguladors hormonals (Lehninger 304).
Proteïnes i Enzims
Cadenes d’aminoàcids
Enllaç peptídic, Estructures primària (seqüència), secundària (plegament en hèlix), terciària (estructura 3D de l’hèlix), quaternària (unió proteïnes). Funcions estructurals, contràctil, reserva, transport, hormona, anticossos.
Mitjantçant enllaços peptídics: Els aminoàcids formen cadenes unint un -NH.H i un -CO.OH amb la pèrdua d’una molècula d’aigua:

Aquestes cadenes tenen entre 100 i 1800 aminoàcids amb pesos moleculars entre 5000 i 106. Es pot arribar a formar una quantitat gairebé il·limitada de proteïnes diferents (>10500). L’home té unes 100.000 proteïnes diferents. Per hidròlisi [captura d’aigua] les proteïnes es descomponen en aminoàcids (p.simples) i algunes en am. més d’altres factors com àtoms metàl·lics (p. conjugades).
La seqüència d’aminoàcids d’una proteïna constitueix la seva estructura primària. Aquesta seqüència es disposa en forma d’hèlix o full plegat (e.secundària) que, a la seva vegada, tindrà una configuració tridimensional allargada (p.fibroses) o enrotllada (p.globulars) (e.terciària). Quan vàries d’aquestes estructures s’uneixen formant un complex es parla d’e.quaternària. (ex. Lehninger p.143)(Atlas p.12).

L’estudi de les p. demana aïllar-les, comesa difícil que s’aconsegueix per les diferències de mida, solubilitat, comportament en un camp elèctric i absorció. Un cop purificades s’estudia l’estructura per raigs x.
Les funcions de les proteïnes són estructurals com el col·lagen i la queratina (parets cel·lulars, ossos i lligaments), contràctils com la miosina i actina de les miofibril·les, de reserva (albúmina de la clara d’ou), de transport com l’hemoglobina que duu O2 en la sang dels vertebrats, de protecció com els anticossos, hormones com la insulina que regula la glucosa a la sang, toxines i enzims. (Lehninger p.66, Atlas p.14).
Enzims
Proteïnes que catalitzen reaccions. Reben el nom -asa segons reacció catalitzada. Vitamines.
Els enzims catalitzen reaccions de biosíntesi accelerant-ne la velocitat de 108 a 1020 vegades. Es denominen segons el substrat que catalitzen més el sufix -asa. Així es classifiquen en oxidoreductases (redox), transferases (porten grups moleculars), hidrolases, liases (deslliguen), isomerases (canvis intramoleculars) i ligases (formen nous enllaços). (Atlas p.14) L’augment de velocitat es caracteritza per la constant de Michaelis-Menten (Lehninger 199) i es deu a una disminució de l’energia d’activació [donen un camí alternatiu]. L’eficàcia i especificitat dels enzims es deu a que la molècula substrat encaixa perfectament en el centre actiu de l’enzim que així el pot transportar i orientar en la posició més favorable [un robot de muntatge a nivell molecular]. Les plantes produeixen els seus propis enzims mentre que els animals els han d’adquirir en forma de vitamines.
Àcids nucleics
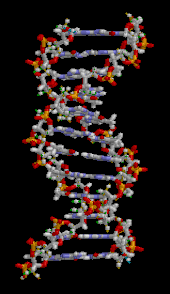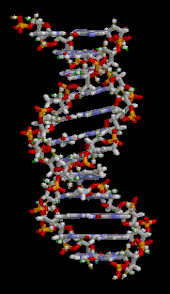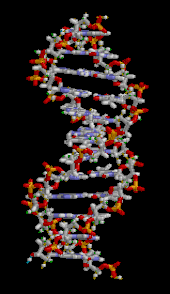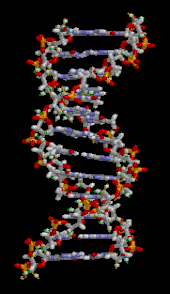
Doble hèlix de cadenes de purines i pirimidines A, G, C, U (RNA), AGCT (DNA) encarades amb ponts d’hidrogen.
DNA Acid desoxirubonucleic, RNA Acid ribonucleic.
Codi genètic
Correspondència entre 4 bases i un aminoàcid (B1500)
Gen fragment de la cadena que codifica una proteïna.
La seqüència d’aminoàcids de les proteïnes està codificada amb una correspondència aminoàcid-3 nucleòtids de RNA (-> codi genètic) que a la seva vegada és una còpia complementària de DNA. El fragment de DNA que codifica una cadena polipeptídica sencera és un gen. Un triplet de 3 bases s’anomena codó. [Uns enzims generen el m-RNA copiant la seqüència corresponent al DNA. Als ribosomes, encaixen amb els t-RNA que porten els aminoàcids corresponents.]
Les purines (Adenina, Guanina) i pirimidines (Citosina, Timina al DNA i Uracil al RNA), juntament amb una pentosa i un àcid fosfòric formen les unitats estructurals dels àcids nucleics.

Aquestes unitats (nucleòtids) s’uneixen amb enllaços covalents (entre l’extrem de l’àcid fosfòric H.O-P i un OH.pentosa). L’anàlisi de les seqüències de DNA o RNA es fa doncs per hidròlisi. (Watson i Crick 1953) L’estructura tridimensional és una doble hèlix de cadenes de nucleòtids on cada base té davant la seva complementària A-T(U) i G-C unida per un pont d’hidrogen (Lehninger p.875).