1743 – 1794 Seguint la tradició familiar fa la carrera d’advocat però pel seu compte estudia botànica amb Bernard de Jussieu, física amb l’abat Nollet, química amb Laplanche i Guillaume François Rouelle, i mineralogia amb Jean Étienne Guettard.
Compra accions de la Ferme générale, una empresa privada contractada pel govern francès per recaptar els impostos indirectes. Es casa amb Marie-Anne Pierrette Paulze, de catorze anys que estudià llatí i anglès, i dibuix amb Jacques Louis David. Il·lustrarà obres de Lavoisier.
El 1772 entra a l’Acadèmia Francesa de les Ciències i munta un laboratori a l’arsenal. Acusat per Marat, serà condemnat i guillotinat.
La combustió i teoria del flogist. Fins aleshores s’explicava la combustió per la presència d’una substància de pes negatiu que s’alliberava en creamr, fusta → cendra + flogist. Però Lavoisier va escalfar en recipients amb aire un diamant, sofre, plom, estany, i va poder observar que es formava una capa d’òxid que pesava més. Per tant alguna mena de material havia passat de l’aire al metall.
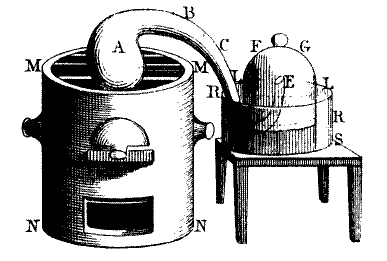
El gasòmetre. El gas obtingut escalfant per una reacció química A passava per un tub a una campana sobre un bany de mercuri (anteriorment aigua) [el desplaçament del nivell d’aigua mesuraria la pressió i volum?].
La composició de l’aire. Va observar que una part de l’aire intervenia en la respiració, combustió i calcinaci, i l’anomena “oxigène”, originador d’àcids. L’altre l’anomena “azote”, sense vida.

La composició de l’aigua. Boyle i Cavendish havien obtingut l’anomenat “aire imflamable” aplicant àcids a metalls. Priestley havia escalfat òxid de mercuri amb llum concentrada i observat que s’alliberava un gas que anomena “aire desflogisticat”. Aquest era el que intervenia en la respiració i la combustió. Combinat amb l’altre, donava aigua, i per això l’anomenà “hidrogène”, generador d’aigua. Fent passar vapor d’aigua damunt ferro molt calent s’obtenia òxid de ferro i hidrogen. Això demostrava que l’aigua no era un element [des dels grecs es pensava que tot estava format per combinació dels quatre elements].
La respiració. Va observar que els animals inspiraven oxigen i expiraven hidrogen de carboni i va especular sobre l’origen de la calor en els animals. Va construir un calorímetre que es mantenia a 0º per un embolcall de gel. Posant un conillet d’índies i mesurant el pes del glaç que s’havia fos tenien una mesura de la clor despresa.


La llei de conservació de la massa. On voit que, pour arriver à la solution de ces deux questions, il fallait d’abord bien connaître l’analyse et la nature du corps susceptible de fermenter, et les produits de la fermentation ; car rien ne se crée, ni dans les opérations de l’art, ni dans celles de la nature, et l’on peut poser en principe que, dans toute opération, il y a une égale quantité de matière avant et après l’opération ; que la qualité et la quantité des principes est la même, et qu’il n’y a que des changements, des modifications. (Al tractat de Química de 1789)
Tractat de Química. 1789 Traité Elementaire de Chimie PDF
- De la formation des fluides aeriformes et de leur descomposition, de la combustion des corps simples & de la formation des acides. (anàlisi de l’aire de l’atmosfera, descomposició del gas oxigen amb sofrem fòsfor i carbó, formació d’àcids, quantitat de calòric en diferents reaccions)
- De la combination des acides avec les bases salifiables & de la formation des dels neutre. (Taules de reaccions químiques).
- Description des Appareils & des Opérations manuelles de la Chimie. (Gasòmetre, calorímetre)
Es descarta definitivament la idea antiga dels quatre elements i es proposen la llum, el calor i 33 elements que no es poden descompondre: oxigen, nitrogen, hidrogen, sulfur, fòsfor, clor, fluor, carboni, ferro, coure, plata, or, mercuri, plom, estany, antimoni, arsènic, bismut, cobalt, manganès, molibdè, níquel, platí, tungstè i zenc. (link)
Els àcids que es formen amb l’oxigen es denominen amb els sufixs “ic” i “ous” segons si tenen més o menys oxigen, per exemple, àcid sulfúric. I les sals corresponents: “ate” (sulfat de coure) o “ite” (sulfit de coure).

